Cos’è la Radioattività?
La radioattività è il fenomeno per cui alcuni nuclei, non stabili, si trasformano in altri emettendo particelle. La radioattività non è stata inventata dall'uomo, anzi, al contrario, l'uomo è esposto alla radioattività fin dal momento della sua apparizione sulla Terra. La radioattività è antica quanto l’Universo ed è presente ovunque: nelle Stelle, nella Terra e nei nostri stessi corpi.
La scoperta della radioattività avvenne alla fine dell’800 ad opera di Henry Bequerel e dei coniugi Pierre e Marie Curie (Figura 1), che ricevettero il Premio Nobel per la Fisica per le loro ricerche. Essi scoprirono che alcuni minerali, contenenti uranio e radio,avevano la proprietà di impressionare delle lastre fotografiche poste nelle loro vicinanze. Le lastre fotografiche, una volta sviluppate, presentavano delle macchie scure.
Per questa loro proprietà, elementi come l’uranio, il radio e il polonio (gli ultimi due scoperti proprio da Pierre e Marie Curie) vennero denominati “attivi” e il fenomeno di emissione di particelle venne detto radioattività. Da allora sono stati identificati quasi 2500 specie di nuclei differenti e di essi solo una piccola percentuale, circa 280, sono stabili.


Figura 1: Henry Bequerel e i coniugi Curie.
Atomi, elementi chimici e isotopi
La materia che ci circonda (aria, acqua, terra, oggetti ed esseri viventi) è costituita da atomi, che a loro volta sono fatti da un nucleo estremamente piccolo, delle dimensioni di un Fermi (1 fm = un milione di miliardi di volte più piccolo di un metro) e di carica positiva, circondato da una nuvola di elettroni di carica negativa (Figura 2).
Il nucleo dell’atomo è costituito dai protoni, carichi positivamente, e dai neutroni, che sono invece privi di carica elettrica e perciò neutri (come dice il loro stesso nome). Il numero di protoni è uguale al numero di elettroni, così che l'atomo è elettricamente neutro.
Figura 2: Disegno schematico di un atomo.
La struttura dell’atomo (nucleo di protoni e neutroni ed elettroni orbitanti intorno al nucleo) è la stessa per tutti gli elementi chimici che conosciamo. Quello che cambia da un elemento all’altro è il numero dei protoni (e quindi degli elettroni) e dei neutroni che l’atomo contiene. Il numero totale di protoni nel nucleo viene chiamato “numero atomico” e si indica con la lettera Z. Esso determina di quale elemento chimico si tratta: così ad esempio l'elemento chimico con 8 protoni è l'ossigeno, quello con 26 protoni è il ferro, quello con 79 protoni è l'oro, quello con 92 protoni è l'uranio e così via.
La somma del numero dei protoni più il numero dei neutroni viene chiamato “numero di massa” e si indica con la lettera A. Mentre il numero di protoni di un elemento chimico è fisso (infatti abbiamo detto che questo numero, Z, caratterizza l’elemento), il numero di neutroni può essere variabile. In questo caso parliamo di “isotopi” di un elemento chimico. Ad esempio: il ferro presente in natura è costituito da 4 isotopi, tutti con 26 protoni ma con 28, 30, 31 e 32 neutroni rispettivamente. Gli isotopi sono identificati dal nome dell'elemento e dal numero di massa, che viene di solito riportato in alto a sinistra del simbolo dell’elemento chimico, per esempio l’isotopo del Carbonio con numero di massa 14 si indica con 14C.
In natura esistono circa 90 elementi (dall'idrogeno, il più leggero, all'uranio, il più pesante) e circa 270 isotopi. Oltre agli isotopi da sempre presenti in natura (isotopi naturali) , esistono oggi un gran numero di isotopi artificiali, cioè prodotti dall'uomo. Esempi di isotopi artificiali sono il cobalto-60 (27 protoni, 33 neutroni), usato in radioterapia e il plutonio-239 (94 protoni, 145 neutroni), usato come combustibile nelle centrali nucleari.
Cos’è un decadimento radioattivo?
Gli isotopi presenti in natura sono quasi tutti stabili. Tuttavia, alcuni isotopi naturali, e quasi tutti gli isotopi artificiali, presentano nuclei instabili, a causa di un eccesso di protoni e/o di neutroni. Tale instabilità provoca la trasformazione spontanea in altri isotopi, e questa trasformazione si accompagna con l'emissione di particelle. Questi isotopi sono detti isotopi radioattivi, o anche radioisotopi, o anche radionuclidi.
La trasformazione di un atomo radioattivo porta alla produzione di un altro atomo, che può essere anch'esso radioattivo oppure stabile. Essa è chiamata disintegrazione o decadimento radioattivo.
Il tempo medio che occorre aspettare per avere tale trasformazione può essere estremamente breve o estremamente lungo. Esso viene detto “vita media” del radioisotopo e può variare da frazioni di secondo a miliardi di anni (per esempio, il potassio-40 ha una vita media di 1.8 miliardi di anni). Un altro tempo caratteristico di un radioisotopo è il “tempo di dimezzamento”, ovvero il tempo necessario affinché la metà degli atomi radioattivi inizialmente presenti subisca una trasformazione spontanea.
Esistono tre diversi tipi di decadimenti radioattivi, che si differenziano dal tipo di particella emessa a seguito del decadimento. Le particelle emesse vengono indicate col nome generico di radiazioni.
Decadimento Alfa (a): Consideriamo un nucleo con numero atomico Z e numero di massa A. In seguito ad un decadimento alfa, il nucleo emette una particella a, cioè un nucleo di elio composto da due protoni e due neutroni, e si trasforma in un nucleo diverso, con numero atomico (Z - 2) e numero di massa (A – 4). Un esempio è il decadimento dell’uranio-238 in torio-234 (Figura 3). Le radiazioni alfa, per la loro natura, sono poco penetranti e possono essere completamente bloccate da un semplice foglio di carta (Figura 4).
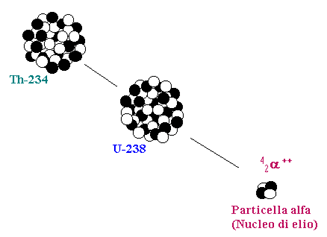
Figura 3: Un decadimento alfa.
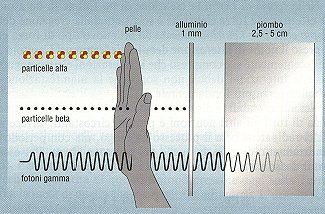
Figura 4: Il potere penetrante delle diverse radiazioni.
Decadimento Beta (b): Il nucleo emette un elettrone e un antineutrino di tipo elettronico (vedi sezione sui neutrini) e si trasforma in un nucleo con numero atomico (Z + 1) ma stesso numero di massa A. Un esempio è il decadimento del Cobalto-60 in Nichel-60 (Figura 5). Le radiazioni beta sono più penetranti di quelle alfa, ma possono essere completamente bloccate da piccoli spessori di materiali metallici (ad esempio, pochi millimetri di alluminio).
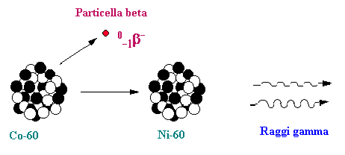
Figura 5: Un decadimento beta con successivo decadimento gamma del nucleo eccitato.
Decadimento Gamma (g): Il nucleo non si trasforma ma passa semplicemente in uno stato di energia inferiore ed emette un fotone. La radiazione gamma accompagna solitamente una radiazione alfa o una radiazione beta. Infatti, dopo l'emissione alfa o beta, il nucleo è ancora eccitato perché i suoi protoni e neutroni non hanno ancora raggiunto la nuova situazione di equilibrio: di conseguenza, il nucleo si libera rapidamente del surplus di energia attraverso l'emissione di una radiazione gamma. Per esempio il cobalto-60 si trasforma per disintegrazione beta in nichel-60, che raggiunge il suo stato di equilibrio emettendo una radiazione gamma (Figura 5). Al contrario delle radiazioni alfa e beta, le radiazioni gamma sono molto penetranti, e per bloccarle occorrono materiali ad elevata densità come il piombo (Figura 4).
Qual’è l’origine della radioattività?
Come abbiamo detto, gli isotopi radioattivi possono avere origine naturale o artificiale. Tuttavia non bisogna pensare che la radioattività naturale e quella artificiale siano fenomeni diversi, in quanto il processo fisico alla base è lo stesso per entrambe.
I radioisotopi naturali hanno avuto origine al centro delle stelle, tramite reazioni nucleari o durante le esplosioni di Supernovae. Alcuni di questi nuclei, come il potassio-40 (40K), il torio-232 (232Th) e l’uranio-235/238 (235U / 238U) sono attivi ancora oggi, in quanto il loro tempo di dimezzamento è di vari miliardi di anni. La misura dell’abbondanza residua di questi isotopi sulla Terra permette di risalire all’età del nostro pianeta, che è calcolata in 4.5 miliardi di anni.
Altri nuclei radioattivi si sono formati in seguito alle interazioni dei raggi cosmici con alcuni elementi. Si parla allora di nuclei di origine cosmogenica. Alcuni esempi sono il carbonio-14 (14C), prodotto dall’interazione dei raggi cosmici con l’azoto dell’atmosfera, il berillio-10 (10Be) e il cobalto-58 (58Co), che si sviluppa in qualsiasi pezzo di rame esposto ai raggi cosmici.
I nuclei radioattivi artificiali sono stati creati in laboratorio o nei reattori nucleari.
La radioattività in natura
La radioattività è un fenomeno naturale: per questo motivo qualsiasi cosa sulla Terra, inclusi i nostri corpi, contiene una certa percentuale di elementi radioattivi.
La radioattività nell’aria è dovuta alla presenza del Radon (Rn). Questo elemento viene prodotto dal decadimento dell’uranio e del torio, che si trovano in moltissimi materiali, soprattutto nelle rocce. Essendo gassoso, il radon riesce ad “evaporare” diffondendosi nell’aria. In 1 m3 di aria in un edificio chiuso avvengono in media 30 decadimenti di radon al secondo.
Un altro protagonista della radioattività naturale è il Potassio-40, che è presente nel nostro corpo e in generale nella materia biologica, nei cibi, nella crosta terrestre e nell’acqua di mare. Per esempio, in un corpo umano si hanno circa 5000 decadimenti di 40K al secondo. La radioattività, inoltre, è responsabile del calore interno della Terra.
Come si misura la radioattività?
L'unità di misura della radioattività è il becquerel (Bq). 1 Bq corrisponde a 1 disintegrazione al secondo. Poiché questa unità di misura è assai piccola, la radioattività si esprime molto spesso in multipli di Bq: il kilo-becquerel (kBq) = 103 Bq, il Mega-becquerel (MBq) = 106 Bq e il Gigabecquerel (GBq) = 109 Bq.
L'unità di misura usata in precedenza era il Curie (Ci) definita come la quantità di radioattività presente in un grammo di radio. Questa unità è immensamente più grande del Bq, perché in un grammo di radio avvengono 37 miliardi di disintegrazioni al secondo. Perciò:1 Ci = 37 GBq = 37 miliardi di Bq.
Quali sono gli effetti della radioattività?
Le radiazioni prodotte dai radioisotopi interagiscono con la materia con cui vengono a contatto, trasferendovi energia. Tale apporto di energia, negli organismi viventi, produce una ionizzazione delle molecole: da qui la definizione di radiazioni ionizzanti. La dose di energia assorbita dalla materia caratterizza questo trasferimento di energia. Gli effetti possono essere irrilevanti o più o meno dannosi, a seconda della dose di radiazioni ricevuta e del tipo di radiazioni.
L'unità di misura della dose assorbita dalla materia a seguito dell'esposizione alle radiazioni ionizzanti é il Gray (Gy). 1 Gy corrisponde a una quantità di energia di 1 Joule (J) assorbita da 1 kilogrammo di materia. Per la misura delle dosi di radiazioni assorbite dall'uomo, o più precisamente per una misura degli effetti biologici dovuti alla dose di radiazioni assorbita, è stato introdotto il concetto di equivalente di dose, che tiene conto della dannosità più o meno grande, a parità di dose, dei vari tipi di radiazioni ionizzanti.
In questo caso, l'unità di misura è il Sievert (Sv). Di uso più comune è il sottomultiplo millisievert (mSv), pari a un millesimo di Sv. Ad esempio, una radiografia al torace comporta l'assorbimento di una dose di circa 0,14 mSv. La dose annualmente assorbita da ogni individuo per effetto della radioattività naturale è in media di 2,4 mSv per anno.
Il limite massimo di dose stabilito dalla legge italiana per le persone è 1 mSv per anno al di sopra della dose naturale di radiazioni (20 mSv per lavoratori impegnati in attività che prevedono l’uso o la manipolazione di radioisotopi).
 |
 |
 |