EFFETTI DI UN AMBIENTE A BASSE DOSI DI RADIAZIONI COSMICHE SUL MANTENIMENTO DI MATERIALE BIOLOGICO CRIOPRESERVATO
Introduzione
I raggi cosmici rappresentano un fattore ambientale permanente coinvolto nell'evoluzione biologica e nell'invecchiamento cellulare (1). Nel corso della selezione naturale, gli organismi viventi hanno sviluppato meccanismi di difesa biologici/biochimici contro i danni causati dalle radiazioni presenti nell'atmosfera terrestre. E' interessante il fatto che diversi organismi e cellule precedentemente esposti a basse dosi di radiazioni o a mutageni chimici possono diventare resistenti a successive esposizioni a radiazioni (capacità
adattativa) (2). Questa capacità adattativa cellulare all'esposizione a raggi cosmici è stata recentemente studiata presso i Laboratori Nazionali del Gran Sasso (LNGS). I LNGS sono provvisti di un laboratorio sotterraneo che offre l'opportunità di valutare gli effetti di un ambiente a bassa radioattività sugli organismi viventi. Gli esperimenti biologici eseguiti nei LNGS (progetti Pulex e Pulex-2) su cellule di lievito (3) e su fibroblasti di criceto (4) suggeriscono che le radiazioni di fondo giocano un ruolo importante nel determinare una serie di processi adattativi cellulari, ed in particolare questi esperimenti hanno evidenziato che cellule cresciute a basse dosi di radiazioni: 1) sono meno protette dai danni al DNA indotti da agenti chimici e fisici; 2) presentano una maggiore sensibilità all'apoptosi; 3) presentano una diversa capacità di far fronte ad agenti ossidanti.
Gli studi fatti nello spazio, dove le radiazioni cosmiche sono superiori a quelle presenti sulla superficie terrestre, hanno consentito di evidenziare i principali bersagli cellulari e le possibili conseguenze causate dalle radiazioni cosmiche. Questi esperimenti hanno dimostrato che le radiazioni cosmiche aumentano i punti di rottura della doppia elica del DNA, le mutazioni indotte (5-7), la perossidazione lipidica (8), la secrezione di citochine (9), ma provocano anche inibizione della proliferazione, del differenziamento cellulare e delle interazioni cellula-cellula, nonché riduzione dell'attività citotossica mediata dal sistema immunitario (5,9). E' stato inoltre osservato che i raggi cosmici inducono l'espressione di p53, una proteina che, bloccando la transizione G1/S del ciclo cellulare e/o causando apoptosi, salvaguarda la stabilità del genoma e quindi protegge dalla formazione di tumori indotti da agenti chimici e fisici (5,6,10). L'insulto radioattivo può indurre rotture del DNA e mutazioni che, in relazione all'estensione del danno ed alla capacità di ripararlo da parte delle cellule, può infine produrre: 1. arresto del ciclo cellulare per permettere il riparo del DNA (normalmente dipendente dalla proteina p53); 2. traslocazioni o delezioni cromosomiche (quando il DNA non viene correttamente riparato) che possono favorire la generazione di cellule tumorali (specialmente in seguito a malfunzionamento della proteina p53); 3. morte cellulare programmata (apoptosi) quando il danno è troppo esteso per essere riparato senza il rischio di generare cellule tumorali (normalmente dipendente dalla proteina p53).
Riassumendo, sebbene i raggi cosmici inducano i sistemi enzimatici in grado di proteggere le cellule dai danni prodotti dalle radiazioni stesse, essi favoriscono anche la formazione di cellule tumorali e l'invecchiamento cellulare. D'altro canto, un espediente per rallentare il processo di invecchiamento di cellule od organismi (che devono essere mantenuti inalterati per lungo tempo) utilizza temperature molto basse. La criopreservazione di cellule, tessuti od organismi (mediante congelamento, vitrificazione o ibernazione) può raggiungere in alcuni casi (al di sotto di -130 °C o 143 °K) il blocco delle attività metaboliche ed il mantenimento in azoto liquido (- 196 °C o 77 °K) o in vapori di azoto liquido (- 150°C o 123 °K) offre la forma più sicura di preservazione. Va comunque tenuto presente che il materiale biologico criopreservato non può riparare i danni prodotti dalle radiazioni di fondo e quindi ci potrebbe essere un a ccumulo di queste alterazioni col tempo . E' perciò possibile che, le cellule crio-preservate dopo scongelamento presentino i tipici aspetti di cellule irradiate (arresto del ciclo cellulare, apoptosi e cancerogenesi), specialmente se sono state conservate per lungo tempo (decenni). E', in effetti, esperienza comune il fatto che la percentuale di cellule vive dopo scongelamento tenda lentamente a ridursi col tempo di criopreservazione (11), in questo caso per valutare completamente la mortalità cellulare (e non solo il rapido processo necrotico) è importante coltivare le cellule per almeno una notte. A questo proposito, r icordiamo che mentre la morte per necrosi è un processo di lisi cellulare rapida e passiva legata ad un forte insulto ambientale (cattivo congelamento o scongelamento, effetti chimici dei crioprotettivi come il DMSO), la morte per apoptosi è un meccanismo attivo e lento (richiede ore o giorni), regolato da un controllo omeostatico cellulare necessario per eliminare le cellule potenzialmente nocive all'organismo (ad esempio le cellule danneggiate che potrebbero trasformarsi in cellule tumorali).
Dati di criocristallografia in cui le macromolecole biologiche vengono sottoposte a radiazioni per la determinazione della loro struttura tridimensionale, suggeriscono che temperature molto basse (100 °K), rallentando la diffusione dei radicali liberi prodotti dalle radiazioni incidenti, riducono notevolmente (pur non bloccando completamente) i danni indotti dai raggi X sulle macromolecole (12). E' interessante il fatto che anche la vitalità eritrocitaria non sembri essere influenzata dalle radiazioni gamma (2500 cGy o 4000
cGy) (13).
Nel complesso queste premesse suggeriscono che la ridotta radiazione di fondo potrebbe favorire il mantenimento delle cellule congelate e quindi la loro vitalità e la ripresa del ciclo cellulare (fenomeni legati alle rotture del DNA indotto dai raggi cosmici) dopo lo scongelamento. D'altro canto, mentre le radiazioni cosmiche influenzano positivamente l'induzione di sistemi di difesa contro le radiazioni stesse e contro altri agenti mutageni in cellule viventi, l'ambiente a bassa radiazione di fondo presente nel laboratorio sotterraneo del Gran Sasso non dovrebbe avere effetti negativi sui sistemi enzimatici di cellule criopreservate. Sebbene molti esperimenti hanno dimostrato che le radiazioni cosmiche possono indurre morte cellulare, tumori ed invecchiamento in cellule vive, la domanda che ci poniamo è: dopo un periodo lungo di conservazione questi stessi effetti sono indotti anche nelle cellule congelate?
Scopo della Ricerca
I principali scopi di questa ricerca sono di:
A) valutare dopo scongelamento le differenze di vitalità (% di cellule vive) e di altre funzioni cellulari in cellule criopreservate (in particolare in cellule progenitrici emopoietiche umane) in presenza di radiazioni di fondo normali o ridotte;
B) valutare dopo scongelamento le differenze di vitalità e di altre funzioni cellulari in cellule prive di nucleo (DNA) (in particolare gli eritrociti), criopreservate in presenza di radiazioni di fondo normali o ridotte. Questo consentirà di valutare gli effetti di perossidazione lipidica delle membrane e di alterazione proteica indotti dalle radiazioni di fondo, svincolati dall'effetto più importante che avviene a livello del DNA.
Per la valutazione della vitalità ed integrità delle cellule criopreservate verranno esaminati dopo scongelamento alcuni parametri cellulari come: 1) la mortalità cellulare (14,17); 2) il ciclo cellulare e
l'apoptosi (14, 16-21); 3) l'espressione di antigeni di superficie con particolare riguardo alle molecole espresse dalle cellule staminali emopoietiche ed alle molecole di adesione che regolano le interazioni cellula-cellula (22-26); 4) la produzione di citochine (27); 5) l'espressione di alcune molecole intracitoplasmatiche come Bcl-2 e p53 (10); 6) la capacità di riparo del DNA da danni indotti da agenti chimici e fisici (14,16-18, 28,29).
Il nostro scopo in sostanza è quello di valutare se nel Laboratorio Sotterraneo del Gran Sasso esistono condizioni vantaggiose per la conservazione di materiale biologico ed in particolare di cellule staminali/progenitrici emopoietiche (CD34+) provenienti da cordone ombelicale o da altra fonte. E' noto infatti che i trapianti di cellule staminali necessari in alcune patologie richiedono la compatibilità tra donatore e ricevente. A questo scopo sono state istituite numerose banche di midollo osseo e di sangue placentare. La ricerca di un donatore compatibile, nel caso di trapianto allogenico, può richiedere anche diverso tempo; d'altro canto nel caso invece di un trapianto autologo, cioè con cellule staminali dello stesso soggetto da trapiantare (da cordone ombelicale o da sangue periferico), le cellule staminali devono essere preventivamente prelevate e conservate integre anche per lungo tempo . La vitalità delle cellule CD34+ (staminali/progenitrici emopoietiche) ha infatti effetti importanti sull'attecchimento di trapianto, pertanto noi riteniamo fondamentale, non solo la qualità del loro congelamento ma anche l'ambiente in cui le cellule vengono conservate. L'identificazione di un ambiente che permetta il mantenimento di materiale biologico congelato (in particolare di cellule staminali di cui il cordone ombelicale è relativamente ricco) per lunghi periodi (anche decenni) senza avere eccessive alterazioni cellulari dopo lo scongelamento, sarebbe molto importante per l'allestimento di una banca di cellule staminali. Questo ambiente potrebbe essere proprio quello con ridotto apporto di raggi cosmici presente nel Laboratorio sotterraneo del Gran Sasso.
Studi di questo tipo potrebbero inoltre far luce sullo stato di deterioramento e sulla sicurezza d'uso di numerose provette e sacche ospedaliere conservate da anni, congelate e mai utilizzate a fini trapiantologici.
Parallelamente, per ottenere dei dati teorici sugli effetti delle radiazione di fondo saranno eseguiti esperimenti su cellule congelate con sorgenti radioattive che simulano la radiazione di fondo.
Materiali e metodi
Saranno utilizzate:
• alcune linee cellulari leucemiche, K562 (radio resistenti), Jurkat (radio sensibili) ed HL-60 (radio sensibili, p53 negative).
• cellule primarie emopoietiche provenienti da sangue periferico e sangue placentare.
Le cellule verranno prima espanse e poi congelate a -80 °C (o 193 °K) nei laboratori del Centro di Citometria e Citomorfologia di Urbino.
Brevemente, le cellule verranno risospese in una soluzione di congelamento (50% FBS, DMSO 10%, 40% RPMI 1640), aliquotate in provette da 2 ml alla concentrazione di 5-50x106
cells/ml e congelate a -80 °C. Quindi le cellule verranno trasportate ai LNGS in ghiaccio secco (-78,5 °C o 194,5 °K) e successivamente mantenute in contenitori con azoto liquido (dewars GT38, Air Liquide, Paris, France) sia nel laboratorio sotterraneo ( Special Technique Service) quindi in condizioni di basse radiazioni sia nel laboratorio esterno ( Chemistry Service ) esposto alle normali dosi di raggi cosmici. Ogni 2 mesi le cellule verranno trasportate in ghiaccio secco nel laboratorio esterno ( Chemistry Service ) e rapidamente scongelate in bagnetto termostatato a 37 °C (o 310 °K).
Per ridurre al minimo le fonti di variabilità, gli esperimenti saranno condotti in triplicato dallo stesso operatore e le radiazioni presenti nei due laboratori verranno continuamente monitorate.
Dopo scongelamento le cellule provenienti da entrambi i laboratori verranno analizzate per valutare:
- la mortalità cellulare subito dopo lo scongelamento e dopo un'incubazione di 12-18 ore (37 °C, 5% CO2
, necessaria per valutare l'apoptosi), mediante colorazione con trypan blue e conta cellulare con camera di Neubauer;
- le rotture del DNA mediante TUNEL o in situ nick translation (14,15);
- la progressione del ciclo cellulare dopo scongelamento mediante incorporazione di Ioduro di Propidio e/o Bromodeossiuridina (14-16);
- il processo apoptotico e la morte cellulare subito dopo scongelamento e dopo un'incubazione di 12-18 ore (37 °C, 5% CO2
, necessaria per valutare l'apoptosi), mediante analisi citofluorimetrica [etanolo/ioduro di propidio o se possibile annessina-V/ioduro di propidio (14, 17,18)], analisi del DNA mediante elettroforesi (ladder) e TUNEL (14,15), analisi morfologica al TEM;
- il ciclo cellulare e proteine annesse [in particolare, p53 (10, 14, 17,18)];
- l'espressione di alcuni antigeni di superficie in particolare molecole espresse dalle cellule staminali emopoietiche (CD34, CD133, CD90, CD135, CD117) e molecole di adesione (CD11a, CD11b, CD11c, CD2, CD54) (22-26);
- la produzione di alcune citochine intracellulari (27);
- la capacità di riparo dei danni indotti sul DNA da specifici agenti chimici (camptotecina) e fisici (raggi ultravioletti) mediante analisi del ciclo cellulare in citometria a flusso (14, 16-18, 28,29);
- l'espressione di Bcl-2 e, se è il caso, l'analisi dello stato perossidativo della membrana cellulare mediante marcatori fluorescenti in citometria a
flusso (10).
L'esperimento che proponiamo di eseguire nei laboratori del Gran Sasso è semplice e ben controllabile. Verranno infatti analizzate dallo stesso operatore aliquote diverse di uno stesso campione di cellule con i medesimi reagenti e strumenti. Infine, per la parte di esperimento da eseguire nel laboratorio sotterraneo sarà necessario uno spazio molto limitato (le dimensioni del contenitore GT38, Fig.1 ) in quanto, in tale sede, il materiale biologico non verrà manipolato.
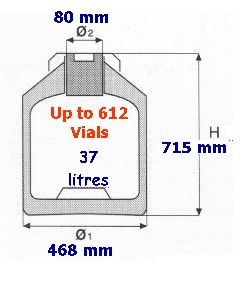
Fig.1 Dewar GT38, Air Liquide, Paris, France
Personale ed attrezzature necessarie
Il personale necessario all'adempimento della parte legata alla valutazione di cellule criopreservate presso i LNGS dovrà essere adeguatamente istruito alle tecniche di coltura cellulare (coltura ed espansione, congelamento e scongelamento di cellule eucariote) ed eventualmente all'analisi di campioni in citometria a flusso.
Saranno necessarie le seguenti attrezzature e reagenti:
• 1 microscopio rovesciato per l'osservazione delle cellule;
• 1 cappa sterile a flusso laminare per la manipolazione in sterilità (splitting e congelamento) delle cellule;
• 1 incubatore per l'espansione delle cellule prima del congelamento;
• 1 bagno termostatato per lo scongelamento delle cellule (37 °C);
• 1 freezer -80 °C per il congelamento graduale (iniziale) delle cellule;
• 2 contenitori di azoto liquido (GT38, Air Liquide, Paris, France) per la conservazione delle cellule uno per ogni laboratorio (laboratorio esterno e sotterraneo);
• 1 centrifuga da banco per i lavaggi;
• 1 citometro a flusso mobile capace di eseguire la conta assoluta cellulare (CyFlow Fig.2 , gentilmente fornito dalla Partec, Munster, Germania);
• 1 camera di Neubauer per la conta cellulare;
• materiale per colture cellulari (fiasche sterili, medium, FBS, vials per congelamento, DMSO, antibiotici, glutamina etc...)
• materiale vario per eseguire le analisi in citometria a flusso (specifici anticorpi e coloranti fluorescenti), al microscopio ottico a fluorescenza (nucleotidi e kit per la TUNEL) ed elettronico (fissativi e materiale per inclusioni).
La possibilità di avere un piccolo citometro da banco per l'analisi citometrica consentirà di eseguire alcune analisi direttamente nel laboratorio LNGS esterno. Comunque, nella maggior parte dei casi le cellule potranno essere trasportate ed analizzate al Centro di Citometria e Citomorfologia di Urbino. La stabilizzazione delle cellule con TRANSFIX® consentirà l'analisi degli antigeni di superficie (30,31), mentre il congelamento o fissazione delle cellule con formaldeide, etanolo o glutaraldeide consentirà rispettivamente la valutazione elettroforetica del DNA (ladder), lo studio delle proteine intracitoplasmatiche, del ciclo cellulare, del DNA (TUNEL) e della morfologia (TEM). Per questi motivi non sarà necessario un lavoro continuativo nel laboratorio sotterraneo, ma la maggior parte dell'attività si potrà svolgere nel laboratorio LNGS esterno o nel laboratorio del Centro di Citometria e Citomorfologia di Urbino. Quest'ultimo è un centro di riferimento a livello internazionale per la valutazione citometrica della mortalità cellulare e dell'analisi delle cellule staminali (vedi pubblicazioni 14-30 , in elenco).

Fig.2 Citometro a flusso mobile capace di eseguire la conta assoluta cellulare (Cyflow, Partec, Germania)


